VEREINFACHTE REGELN ZUR SÄULEN- UND LÖSUNGSMITTELAUSWAHL IN DER RP-HPLC (KURZHINWEIS)
Die Kieselgelmatrix und die Teilchengröße
Stark kontaminierte Probe, schwierige Matrix z. B: biologisches Material, Umweltprobe, Pflanzenextrakt, Lebensmittel, Tierfutter, Stärke, Polymermatrix etc.? Denke zunächst an Monolithen (z. B. Chromolith Performance/Onyx). Soll es doch ein poröses Material werden, so tendenziell eines mit großer spezifischer Oberfläche (> 350 m2/g). Ferner: Ist Gradientelution vorgesehen, da mehr als ca. 10-15 Peaks erwartet werden? Wenn beide Fragen (schwierige Matrix, Gradient) mit „ja“ zu beantworten sind: Mit Fokus auf eine lange Lebensdauer der Säule, wäre im Falle eines porösen Materials zunächst 5 µm vorzuziehen; nur wenn in der Routine gründliche Probenvorbereitung gewährleistet werden kann und viele Peaks zu trennen sind (große Peakkapazität nötig), wäre evtl. auch an 3-3,5 µm-Material oder gar kleiner zu denken
Die Säulendimensionierung
- Erwartest du ≤ 10 Peaks und siehst du ferner Gradientelution vor? Säulenlänge: Eher 50 mm, 100 mm geschweige denn länger dürfte in der Regel nicht notwendig sein; für 20-25 Peaks, 100-125 mm, für ≥ 30-40 Peaks, 150-200 mm
- Erwartest du weniger als ca. 10 Peaks und soll es eine robuste, isokratische Methode für die Routine werden? Eine 100 mm lange Säule sollte ausreichend sein
- Erwartest du geringe Konzentrationen? Denke an eine 3 mm-Säule; hast du keine schwierige Matrix und auch der Druck bereitet dir kein Kopfzerbrechen? Dann solltest du an eine 2,1 mm-Säule denken
Die stationäre Phase
Enthält die Probe folgende Substanzen?
- ausgeprägt polare Komponenten wie z. B: Dipole, starke Säuren/Basen, halogenierte Moleküle, Farbstoffe, Flavonoide, Carotinoide, underivatisierte Säuren, Aminozucker, Phospholipide, Metaboliten, (teilweise) ionisch vorliegende Spezies, Zwitterionen
- sterisch anspruchsvolle Strukturen (z. B: verdrillte Moleküle, Steroide)
- unsubstituierte, mehrkernige Aromaten
- „schwierige“ Isomere (z. B: Stellungs-/Positions-/Struktur-Doppelbindungsisomere)
- chemisch sehr ähnliche Moleküle…
…dann eignen sich eher polare stationäre Phasen, z. B: Silanol-haltige Materialien, PFP- (Pentafluorphenyl), Biphenyl-, Mixed-Mode-, EPG- (Embedded Polar Group) Phasen. Probleme bzgl. Zuverlässigkeit im Alltag (Chargenreproduzierbarkeit, Schwierigkeiten bei der Validierung etc.) müsstest du jedoch in Kauf nehmen. Bemerkung: Der Hinweis „polare stationäre Phasen“, zielt auf eine größtmögliche Selektivität; dies bedeutet also keinesfalls, dass an hydrophoben Materialien eine zufriedenstellende, für den vorliegenden Zweck ausreichende Selektivität für polare Komponenten nicht möglich wäre.
Für alle andere Fälle wie…
- apolare Komponenten, z. B. es besteht ein geringer Unterschied in der Hydrophobizität
- apolare und polare Komponenten (z. B. Wirkstoff/Metabolit, ∆ Anzahl CH2-Gruppen, CH3– vs. OH-Gruppe)
- gesättigte Aromaten, kein Heteroatom
- nicht ionische, eher schwach polare Komponenten (z. B. Aldehyde, Ketone oder auch schwache Säuren)
…eignen sich eher hydrophobe (apolare), endcappede Phasen
Das Lösungsmittel
Methanol zeigt für die Trennung von polaren Komponenten im Vergleich zu Acetonitril oft die bessere Selektivität, so werden beispielsweise π-π-Wechselwirkungen in Acetonitril unterdrückt. Verwende eher Acetonitril im Falle von apolaren Komponenten.
AUSFÜHRLICHE ERLÄUTERUNG
Zusammenfassung von Kernaussagen
Als erstes erfolgt eine Zusammenfassung von Kernaussagen:
- Mit Acetonitril und Puffer – stärker im Alkalischen – macht man eine Art „Gleichmacherei“, die individuellen Unterschiede der stationären Phasen bzgl. Selektivität kommen kaum zum Tragen
- „Polare Komponenten und/oder ähnliche Strukturen? Verwende eine polare Säule plus Methanol (plus niedrige Temperatur, z. B. 10-15 °C)“
- „Mit Methanol zeigen die Säulen eine viel größere Bandbreite bzgl. Selektivität“
- „Sind (zusätzliche) polare Wechselwirkungen möglich, kommen die individuellen Unterschiede der stationären Phasen bzgl. Selektivität zum Tragen“. Das ist der Fall, wenn der Analyt einen ausgeprägten polaren Charakter aufweist oder aber wenn er (teilweise) ionisch vorliegt. Bezüglich stationärer Phase bedeutet dies eine (zusätzliche) polare/ionische Gruppe. Das kann eine aktive Silanolgruppe sein oder eine funktionelle polare Gruppe wie dies beispielsweise bei EPG-, PFP, Biphenyl-, Amid/Carbamat (EPG)- oder Mixed-Mode-Phase der Fall ist
- „Eine gute aromatische Selektivität zeigen solche stationäre Phasen, die entweder eine Polymer-/polymerisierte Schicht an der Oberfläche aufweisen oder aber vor allem zu polaren Wechselwirkungen befähigt sind“
- „Im Falle von unbekannten Proben: Ein Testen mit wirklich orthogonalen Säulen ist angebracht“. Und: „Es ist von Vorteil mehrere Wechselwirkungsmechanismen gleichzeitig zu ermöglichen!“
- „Alternative Strategie bei Nicht-Verwendung eines Säulenwechslers: „Gute“, klassische, C18-Säule plus anschließender Test mithilfe einer/mehreren „ganz“ anderen Säule(n) zur Bestätigung der Selektivität“
Methanol vs. Acetonitril
„Mit Acetonitril und Puffer geraten Unterschiede in den Hintergrund“. Bei einem bestimmten pH-Wert des Eluenten werden je nachdem saure bzw. basische Moleküle neutralisiert, der evtl. verwendete Puffer sorgt für einen konstanten pH-Wert. Die/einige Komponenten liegen demnach in neutraler Form vor, somit herrschen mit einem RP-Material vorwiegend neutrale Wechselwirkungen. Nun, es gilt: Neutrale, hydrophobe, also typische RP-Wechselwirkungen sind nicht besonders charakteristisch, das Ergebnis lautet: Die individuellen Unterschiede der Komponenten (z. B: Unterschiede im polaren/ionischen Charakter) geraten in den Hintergrund. Das gilt auch für die stationären RP-Phasen: Evtl. zusätzlich vorhandene polare Gruppen (Silanolgruppen, weitere polare Gruppierungen), – welche gerade für die Unterschiede zwischen den Phasen stark verantwortlich sind –, können eben gegenüber neutralen Species kaum in Aktion treten. Dieser Effekt ist mit Acetonitril im Eluenten wesentlich ausgeprägter als mit Methanol. Vereinfachte Schlussfolgerung: Mit Acetonitril und Puffer – stärker im Alkalischen – macht man eine Art „Gleichmacherei“, die individuellen Unterschiede der Komponenten und der stationären Phasen bzgl. Selektivität kommen kaum zum Tragen. Das ist der Hauptgrund, warum bei Anwendung von Acetonitril und Puffer unterschiedliche Säulen häufig recht ähnliche Chromatogramme liefern, siehe dazu folgende zwei Beispiele: Obwohl die vier hier verwendeten Säulen von Waters sehr wohl unterschiedliche Eigenschaften aufweisen, ergeben sich recht ähnliche Chromatogramme. Dies gilt sowohl für die Trennung von Basen als auch für Säuren.
Der hier beschriebene Tatbestand gilt auch für ungepufferte Systeme, siehe weiter unten.
„Methanol: Vorteile im Falle von polaren Komponenten und polaren Phasen“
Auch in einer bewusst ungünstig gewählten Konstellation (starke Basen und saurer Puffer) zeigt sich Methanol als vorteilhaft: 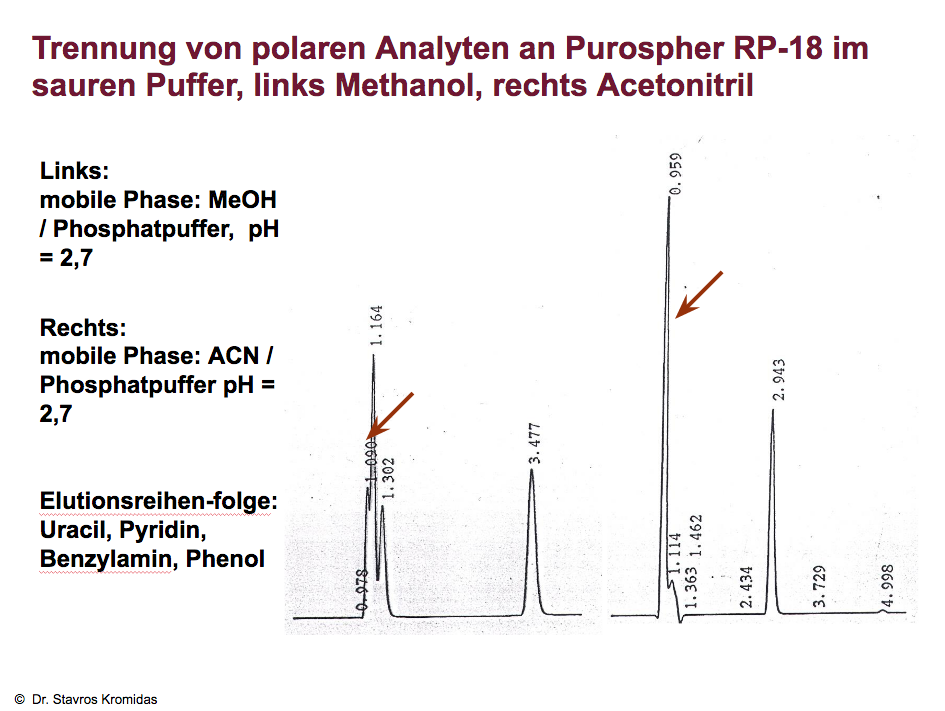
Trotz des „falschen“ pH-Wertes werden die Peaks immerhin angetrennt (linkes Chromatogramm), mit Acetonitril als organischem Lösungsmittel erhält man nur einen Peak (rechtes Chromatogramm). Auch im Falle von starken Säuren ist die Selektivität mit Methanol besser als mit Acetonitril (linkes vs. rechtem Chromatogramm).
Imfalle von Molekülen mit ähnlicher Struktur (Isomere, Phospholipide, Steroide usw.) sind für die Trennung polare Wechselwirkungen von Vorteil, d. h. es werden Säulen mit einem polaren Charakter benötigt. Ferner zeigt Methanol für polare Komponenten auch in diesem Fall oft eine bessere Selektivität im Vergleich zu Acetonitril. Dazu folgendes Beispiel: Eine Mischung aus Uracil, Anilin, Phenol, o-, m-, p-Toluidin, Ethylbenzol und Fluorenon wurde bei 60/40 Methanol/Wasser auf unterschiedliche Säulen injiziert. Klassische, endcappede C18-Phasen können den drei Stellungsisomeren keine polare Wechselwirkungen anbieten, das Ergebnis: Man erhält nur zwei Peaks für die drei Isomere, die Chromatogramme mit derartigen Säulen sehen fast identisch aus, XSelect HSS C18 und XSelect HSS T3, XSelect CSH C18 und Cortecs C18 sowie Kinetex C18 und Kinetex EVO C18.


Sobald polare Wechselwirkungen möglich sind (Silanolgruppen, PFP-Gruppe usw.), wird die Selektivität für die Trennung der Toluidine verbessert, beachte auch im Falle der polaren Materialien die Elutionsumkehr bei Ethylbenzol/Fluorenon (blauer Pfeil), siehe auch weiter unten. Zusätzliche polare Wechselwirkungen führen jedoch häufig zu einer Verschlechterung der Peakform (langsame Kinetik). Vereinfachte Empfehlung: „Polare Komponenten und/oder ähnliche Strukturen? Nimm´ eine polare Säule plus Methanol (plus niedrige Temperatur, z. B. 10-15 °C) für eine gute Selektivität und sei bereit, Kompromisse bzgl. Peakform und Retentionszeit- sowie Säulenstabilität und Chargenreproduzierbarkeit einzugehen“.
Dazu noch zwei weitere Beispiele:
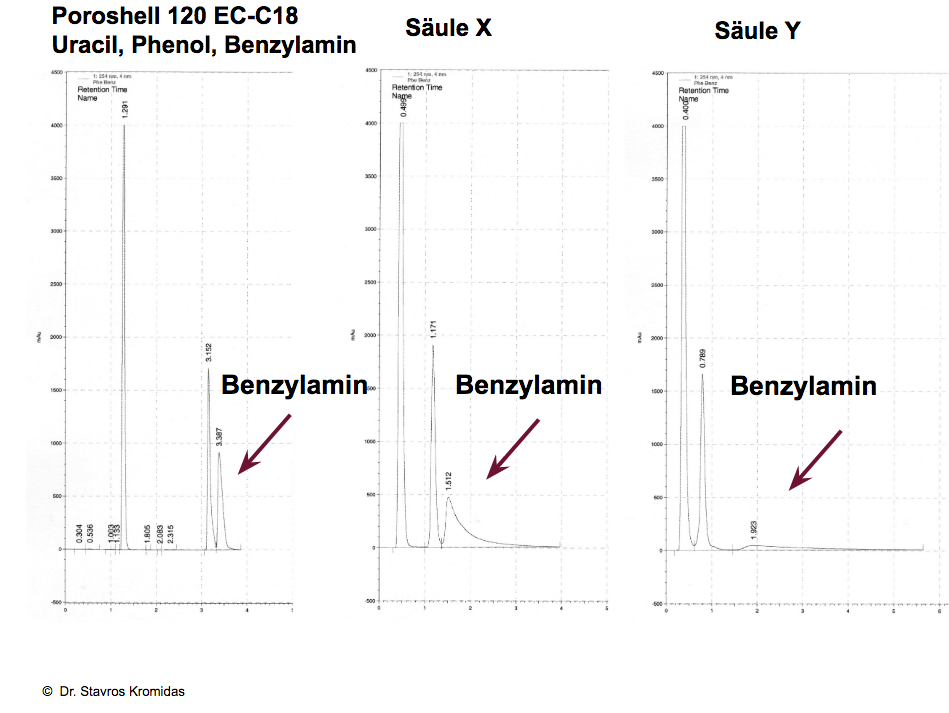
Hier wird die Trennung von polaren Komponenten gezeigt, links mit Methanol, rechts mit Acetonitril. Befunde: Mit Methanol wird eine sehr polare Komponente nahezu Basislinie vom Totzeitpeak (Uracil) abgetrennt, ferner werden auch Phenol und Benzylamin gut abgetrennt. In Acetonitril wird die polare Verunreinigung am Totzeitpeak gerade noch als „Buckel“ angedeutet, Phenol und Benzylamin koeluieren.
In diesem Diagramm werden die alpha-Werte bei der Trennung von zwei Isomeren, 3- und 4-Nitroanilin, an diversen Säulen gezeigt, blau in Acetonitril, rot in Methanol. Befunde: Die alpha-Werte bewegen sich in Acetonitril zwischen ca. 1,0 und 1,35, in Methanol zwischen ca. 0,85 (Elutionsumkehr) und 1,45. Das bedeutet: „Mit Methanol zeigen die Säulen eine viel größere Bandbreite bzgl. Selektivität“.
Polare und apolare Wechselwirkungen
Wie bereits weiter oben angemerkt, sind neutrale Wechselwirkungen nicht besonders charakteristisch. Solche ergeben sich im Falle von neutralen oder über den pH-Wert neutralisierten Komponenten. In solchen Fällen können die stationären Phasen ihre Individualität bzgl. Selektivität kaum entfalten, dazu drei Beispiele:
In diesem Diagramm stellen die Balken die alpha-Werte bei der Trennung von Ethylbenzol/Toluol, einem typischen RP-Analytpaar (Methylengruppenselektivität, Differenz lediglich eine CH2-Gruppe), an diversen Säulen dar. Die alpha-Werte auch an recht unterschiedlichen Säulen – z. B. Symmetry C18 und Platinum EPS – sind einander sehr ähnlich, die Werte bewegen sich insgesamt zwischen ca. 1,30 und 1,45. Sind dagegen auch polare Wechselwirkungen möglich, so z. B. lediglich durch einen zusätzlichen Sauerstoff bei der Trennung von Fluoren/Fluorenon, ergeben sich alpha-Werte zwischen ca. 1,5 und 3,4. Auch bei der Trennung von Ethylbenzol/Fluorenon bewegen sich aufgrund zusätzlicher polarer Wechselwirkungen die alpha-Werte zwischen ca. 0,45 (Elutionsumkehr) und 1,75. Man kann wie folgt festhalten: „Sind (zusätzliche) polare Wechselwirkungen möglich, kommen die individuellen Unterschiede der stationären Phasen bzgl. Selektivität zum Tragen, ansonsten sehen die Chromatogramme recht ähnlich aus“.
Vereinfacht gilt: „Gleiches mit Gleichem“, z. B: Starke Säuren liegen (teilweise) ionisch vor, für eine gute Selektivität werden stationäre Phasen mit einem polaren Charakter benötigt, siehe dazu beispielhaft folgendes Ergebnis bei der Trennung von schwachen und starken Säuren:
Die starken Säuren Phthal-/Terephthalsäure werden am polaren XBridge Shield RP-18-Material besser abgetrennt als die zwei schwachen Säuren 3-/4-Hydroxybenzoesäure (alpha-Wert blaue Balken). Das Paar 3-/4-Hydroxybenzoesäure wird hingegen am hydrophoben XBridge C18-Material besser abgetrennt (alpha-Wert rote Balken).
„Eine gute aromatische Selektivität zeigen solche stationäre Phasen, die entweder eine Polymer-/polymerisierte Schicht an der Oberfläche aufweisen oder aber zu polaren Wechselwirkungen befähigt sind“, siehe Diagramm: Die polare Version von Acclaim (Acclaim PA C16) zeigt eine bessere Selektivität für die Trennung von Chrysen/Perylen im Vergleich zu hydrophobem Acclaim C18: Die gelbe Linie entspricht den alpha-Werten. Ferner gilt keinesfalls: Stärkere Wechselwirkung = bessere Selektivität. Aromatische Verbindungen machen einen großen Teil der zu trennenden Komponenten in der HPLC aus. Mithilfe von Selektivitäts-Netzdiagrammen können die hier vorgestellten Regeln zur Trennung von polaren und apolaren aromatischen Verbindungen beispielhaft demonstriert werden
Wie beeinflusst die Charakteristik der Phasenoberfläche die Selektivität?
Phasen, die eine gute hydrophobe Selektivität zeigen, befinden sich im oberen Bereich der Übersichts-Selektivitätskarte (großer alpha-Wert Ethylbenzol/Fluorenon). Das sind Phasen, die folgende Charakteristika aufweisen: Große Belegungsdichte (grob: ca. > 17-18 % C), und/oder „Polymer-Bonding“, ferner kaum aktive (= acide, dissoziiert vorliegende) Silanolgruppen – das sind die „guten“, klassischen C18-Phasen. Bei stark polaren Phasen wie beispielsweise Mixed-Mode-, Biphenyl- oder PFP-Phasen ergibt sich Elutionsumkehr, die Selektivität ist – bei negativen alpha-Werten! – ebenfalls sehr gut
Hier sollte wie folgt unterschieden werden:
Silanophile Phasen, also Phasen, die über dissoziierte Silanolgruppen verfügen. Das sind beispielsweise ältere, nicht endcappede Materialien, jene weisen eine starke Silanophilie auf, z. B: Zorbax ODS, Hypersil ODS, Spherisorb ODS 1, Bondapak C18, LiChrosorb C18, LiChrospher 100 RP-18/Superspher 100 RP-18. Die Silanolaktivität ist bei basischen Proben im neutralen/sauren Bereich besonders stark ausgeprägt: Sehr starke Wechselwirkungen beispielsweise mit protonierten N-haltigen Molekülen – bis hin zur irreversiblen Sorption an der Oberfläche. In der Regel ergibt sich eine gute Selektivität für stark polare Moleküle bei allerdings oft stark asymmetrischer Peakform. Liegen die Moleküle nicht in ionischer Form vor, sind also Ionenaustausch-Wechselwirkungen nicht möglich, treten die anderen Charakteristika der betreffenden Phase in den Vordergrund. So zeigt beispielsweise Zorbax ODS wg. seines relativ hohen Kohlenstoffgehalts zusätzlich eine durchaus gute hydrophobe Selektivität. Eine Reihe von moderneren, gründlich endcappeden Phasen zeigt dagegen auch beim sehr strengen Benzylamintest kaum eine Silanolaktivität: Auch starke Basen eluieren mit einer guten Peakform, z. B: PoroShell 120 EC C18, C18, XSelect, PoroShell 120 HPH C18, Cortecs, C18, XSelect HSS C18, XBridge C18, YMC Pro bzw. YMC Pro C18 RS .
- Zusammengefasst: Sind ionische/recht polare Wechselwirkungen für die Trennung notwendig, kannst du weiterhin an ältere Materialien denken, siehe weiter oben. Selbstverständlich auch an modernere nicht-endcappede Materialien wie Poroshell 120 SB C18 oder an PFP-Säulen oder Mixed-Mode-Materialien wie Primesep A oder Obelisc R, allerdings: Lange Retentionszeiten, sehr starke pH-Wert-Abhängigkeit und evtl. Tailing müssten u. U. in Kauf genommen werden. Ist dagegen die Selektivität durch klassische RP-Wechselwirkungen gegeben (Bestätigung mithilfe von orthogonalen Tests!)? Dies bedeutet wohl, dass der hydrophobe Charakter der Analyten recht ausgeprägt ist. In diesem Fall wären Materialien, die weiter oben beispielhaft aufgeführt sind, sicherlich eine gute Wahl: Bei zufriedenstellender Selektivität kann man eine sehr gute Peakform und eine lange Lebensdauer der Säule erwarten. Üblicher- und sinnvollerweise wird in solchen Fällen mit Acetonitril gearbeitet
- Undissoziierte Silanol- und weitere polare Gruppen; Phasen mit einem polaren Charakter werden für die Trennung polarer Moleküle benötigt. Das sind Phasen, die sich auf der rechten Seite der Übersichts-Selektivitätskarte befinden (großer alpha-Wert Tri/o-Ter). Eine besonders gute sterische Selektivität – z. B: Trennung von Isomeren – weisen Phasen mit einer PFP-(Pentafluorphenyl) oder einer EPG-Gruppe (Eingebaute Polare Gruppe) oder aber Phasen mit einer großen Belegungsdichte und/oder „Polymer-Bonding“ auf.
Zusammengefasst: Für eine gute polare bzw. eine gute sterische Selektivität sind Phasen auf der linken Seite der Übersichts-Selektivitätskarte weniger geeignet. Sollte man sich dennoch aus welchen Gründen auch immer für eine Phase aus diesem Bereich entscheiden: Eine Phase mit freien Silanolgruppen wäre einer ausgesprochen gut abgedeckten, hydrophoben, endcappten Phase vorzuziehen. Die unterschiedlichsten Chromatogramme (sprich: Die unterschiedlichen Eigenschaften der Phasen werden sichtbar) erhält man, wenn an erster Stelle, ionische Wechselwirkungen bzgl. Selektivität eine wichtige Rolle spielen. An zweiter Stelle tritt die sterische Selektivität – auch hier kommen die Unterschiede der Phasen zum Vorschein, siehe auch weiter unten. Die Wahl der stationären Phase schließlich im Falle von schwachen, undifferenzierten, apolaren Wechselwirkungen ist relativ unwichtig, die benötigte Selektivität kann bei Bedarf eher über die mobile Phase erreicht werden.
Kaum Informationen über die Probe
„Große Säulendiversität beim Testen notwendig!“
Bei unbekannten Proben ist es zeitsparend, die geeignete Säule durch Verwendung eines Säulenwechslers zu finden. In solchen Fällen sollten mithilfe z. B. der Selektivitätskarten oder der Balkendiagramme wirklich unterschiedliche Säulen getestet werden – nicht lediglich mehrere C18-Säulen. Das betrifft nicht nur den chemischen Charakter der stationären Phase sondern auch den Porendurchmesser.
Nachfolgend drei Beispiele:
- An den zwei C18-Säulen, LiChrosorb C18 und Reprosil-PUR AQ, mit einem Porendurchmesser von 100 Å bzw. 120 Å erscheinen fünf Hauptpeaks, an Jupiter C18, ebenfalls einem C18-Material, allerdings mit einem Porendurchmesser von 300 Å sechs Hauptpeaks. Solche sterische Effekte werden also nicht nur bei großen Molekülen sondern auch bei kleineren Molekülen mit Molekulargewichten kleiner ca. 300-350 Dalton beobachtet.


- An mehreren modernen, endcappten C18-Säulen wurden drei Peaks gefunden (rechtes Chromatogramm). An stark polaren Phasen (Mitte: Fluorierte Phase, rechts sehr stark silanophile Phase) konnten die zwei starken Basen (die rechts als ein recht schmaler Peak koeluieren - erster Peak -) abgetrennt werden, man erhält vier Peaks.

3. Jahrelang wurde mit vielen unterschiedlichen C18-Phasen stets ein früh eluierender unbekannter Peak erhalten, so auch an der polaren stationären Phase Polaris C18 A (links) und an der hydrophoben, endcappten Discovery C18 (Mitte), siehe Chromatogramm. Man hat es akzeptiert. Erst durch den Einsatz von Primesep C, einer C18-Phase mit zusätzlichen Komplexbildungseigenschaften, konnte festgestellt werden, dass der erste unbekannte Peak keinesfalls homogen war. Die Konsequenz lautet:
„Im Falle von unbekannten Proben ist ein Testen mit wirklich orthogonalen Säulen angebracht“.
- „Es ist von Vorteil mehrere Wechselwirkungsmechanismen gleichzeitig zu ermöglichen!“
Mehrere Tests mit unterschiedlichen Verbindungen und bei unterschiedlichen Bedingungen haben folgendes gezeigt: Es gibt Säulen, die für recht unterschiedliche Substanzklassen eine durchweg gute Selektivität zeigen („Universalselektivität“). Nur für den Fall, dass ein Säulenwechsler nicht verwendet werden kann: Solch´ eine Säule könnte als quasi zweitbeste Alternative die Rolle einer „Start-Universalsäule“ für unterschiedliche, unbekannte Proben übernehmen. Beispiele für solche Säulen wären: LiChrospher RP-C18 bzw. Superspher RP-C18, Purospher, Atlantis T3, Nucleosil AB, YMC Pro C18 RS, SMT OD C18, Primesep C, XSelect CSH Fluoro-Phenyl.
Diese Materialien verfügen über bestimmte Eigenschaften, die ihnen für eine Reihe von unterschiedlichen Substanzklassen eine gewisse ausgewogene Selektivität bescheren.
Kurzkommentare:
Nucleosil AB (25 % C), YMC Pro C18 RS (22 % C) und SMT OD C18 (24 % C): Starke Belegung, quervernetzte, quasi Polymerschicht an der Oberfläche. Dies ist sowohl für die Trennung von apolaren/polaren Komponenten als auch für aromatische Verbindungen generell als auch speziell in punkto sterische Selektivität von Vorteil.
Purospher: Mit Aminogruppen endcappedes Material, somit polarer Charakter. Ferner mit 500 m2/g eine große spezifische Oberfläche und mit ca. 3 µmol/cm2 eine starke Belegung der Oberfläche.
Atlantis T3: Trivalente Bindung aber gleichzeitig sehr niedrige Belegung.
Primesep C: Es handelt sich dabei um eine Mixed-Mode-Phase mit Alkylketten und einer zusätzlichen Kompexbildung-fähiger Gruppe. Ein pKs-Wert von 3,5 beschert dem Material ferner eine gute Selektivität von sauren Komponenten. Hier nicht gezeigte Experimente belegen, dass dieses Material tatsächlich eine große Oberflächen-Diversität aufweist
LiChrospher RP-C18 und Superspher RP-C18; als ältere Materialien verfügen sie sowohl über acide als auch über undissoziierte Silanolgruppen, ferner auch über Metallionen in der Kieselgelmatrix. Mit 17-21 % C ist schließlich der hydrophobe Charakter recht ausgeprägt. Solche Materialien bieten den Probemolekülen unterschiedliche Wechselwirkungen an: Hydrophobe, Ionenaustausch-, Dipol-Dipol-Wechselwirkungen, über das freie Elektronenpaar bei vorhandenen Siloxan-Bindungen auch π-π-Wechselwirkungen, schließlich Wasserstoffbrücken-Bindungen und auch Komplexbildung über die vorhandenen (ungewollten) Metallionen in der Kieselgelmatrix. Die Wahrscheinlichkeit für die Trennung von unterschiedlichen Molekülen ist somit gegeben.
XSelect CSH Fluoro-Phenyl: Starke Belegung, geladene Gruppen, Silanolgruppen, elekronenreiche Fluoratome, Ergebnis: Auch hier eine große Diversität an Wechselwirkungen möglich.
„Alternative Strategie zu „A“ und „B“: „Gute“, klassische, C18-Säule plus anschließender Test mithilfe einer/mehreren ganz anderen Säule(n) zur Bestätigung der Selektivität (orthogonaler Test, siehe weiter oben).
Nehmen wir an, es gilt eine Reihe von eher unproblematischen Substanzen zu trennen, z. B: neutrale/über den pH-Wert neutralisiert, schwach polare, nicht-geladene Moleküle (Aldehyde, Ketone schwache Säuren/Basen, Aromaten mit neutralen Substituenten), „einfache“ Isomere. In diesen Fällen wäre der Start mit einem klassischen C18-Material angebracht. Als Beispiele von hydrophoben Core Shell-Materialien wären zu nennen: PoroShell 120 EC C18, CORTECS C18, Kinetex EVO C18, Accucore C18, Nucleoshell RP C18. Beispiele von hydrophoben porösen Materialien: Zorbax Eclipse PLUS C18, XSelect HSS C18, XBridge C18/BEH C18, YMC RS C18, Acclaim C18, Nucleodur Gravity C18, Titan C18. Ein anschließender orthogonaler Test mit einer/zwei polaren Säule(n) zur Bestätigung der Selektivität/Peakhomogenität wäre in jedem Fall empfehlenswert. Dazu eignen sich beispielsweise folgende Materialien: PFP, EPG, Mixed-Mode, Biphenyl, evtl. auch 60-80 Å – und/oder 300 Å -Materialien plus alternativ zu Acetonitril: Methanol bzw. ca. 10 % Acetonitril gegen Tetrahydrofuran oder MTBE (tert.Methyyl.Butylether) ersetzen.
Bei welchen Analyten machen sich die Selektivitätsunterschiede der Phasen am stärksten bemerkbar?
Vereinfachte Regel:
Die geringsten Unterschiede werden sichtbar bei neutralen Molekülen (evtl. über den pH-Wert neutralisiert) und Acetonitril/Wasser-Gemischen.
Die größten Unterschiede ergeben sich bei ionisch vorliegenden Molekülen – z. B. einer starken Base – und Methanol/Wasser-Gemischen. Befunde aus den hiesigen Experimenten ergeben folgendes: Unterscheiden sich die Komponenten in der Molekülgröße und in der Polarität („=O“, „OH“, Aromatizität, Stellung der funktionellen Gruppe etc.) ergibt sich als Unterschied in der Selektivität bei den stationären Phasen ein Faktor bei den alpha-Werten von ca. 3-3,5 (alpha EB/Fl). Handelt es sich andererseits beim Unterschied lediglich um eine Methyl- oder Ethylgruppe wird der Faktor bei den alpha-Werten unter Berücksichtigung aller untersuchten Säulen auf ca. 1,1-1,4 (alpha Propbenz/Methbenz, Propyl-3-Hydroxybenzoat/Methyl-3-hydroxybenzoat) reduziert: Die Phasen liefern recht ähnliche Chromatogramme. In dieser Reihenfolge bzgl. Merkmalen der zu trennenden Komponenten kommen die Unterschiede der stationären Phasen zunehmend zum Tragen: ∆ CH2/CH3-Gruppe, mehrkernige Aromaten, planare/nicht-planare Moleküle, halogenierte Substanzen, Isomere, kleine polare Aromaten, starke Säuren/Basen. Bei Letzteren dürfte der polare Charakter natürlich nicht durch den pH-Wert und/oder die Verwendung von Acetonitril herabgesetzt werden, siehe weiter oben. Nachfolgende Tabelle umfasst das weiter oben gesagte und zeigt, mit welchen Selektivitätsunterschieden man zwischen stationären Phasen abhängig von der Art des Analyten rechnen kann.
|
Art der Selektivität |
Unterschied(e) der zu trennenden Analyten |
Zugrunde liegender Trennfaktor alpha |
|
| Hydrophobe Selektivität (Trennung polarer/apolarer Komponenten) | ∆: CH2 | α EB/T | 1,14 |
| ∆: CH2 + O | α Propbenz/Ethbenz | 1,17 | |
| ∆: 2 x CH2 + O | α Propbenz/Methbenz | 1,45 | |
| ∆: =O | α Fluoren/Fluorenon | 2,25 | |
| ∆: =O + ∆ Aromatizität + ∆ Molekülgröße | α EB/Fl | 3,54 | |
| Aromatische Selektivität
(π-π-Wechselwirkungen) |
∆ aromatischer Charakter | α Per/Chr | 1,76 |
| Sterische Selektivität
(Zugänglichkeit, π-π-Wechselwirkungen) |
∆ räumliche Anordnung | α Tri/o-Ter | 3,65 |
| Polare Selektivität 1
(Wasserstoff-Brückenbindungen) |
∆ OH- vs. Alkylgruppe | α Phe/EB | 15 |
| Polare Selektivität 2
(Ionenaustausch-Wechselwirkungen) |
∆ Ionenaustausch-fähiger/unfähiger Komponenten, ∆ Ladung | α Benz/Phe | Ø 20 |
Diese Tabelle macht deutlich, warum genau definiert werden sollte, um welche Art von Analyten es sich handelt, bevor eine Aussage gemacht werden kann: „Diese Säule ist ähnlich mit…“ Geht es beispielsweise um die Trennung von neutralen/neutralisierten Komponenten, verhalten sich auch unterschiedliche stationäre Phasen recht ähnlich (Fall 1, geringe Selektivitätsunterschiede). Mit der Erhöhung von zusätzlichen polaren Wechselwirkungen bzw. der Anzahl von möglichen Mechanismen treten die Unterschiede immer stärker hervor. Sie gipfeln sich im Fall von zusätzlichen Ionenaustauschwechselwirkungen und mit Methanol als organischem Lösungsmittel (Fall 5, sehr große Selektivitätsunterschiede).
Kombination stationäre Phase und Komponenten – was kann man erwarten?
„Gleiches“ mit Gleichem !?
- Hydrophobe stationäre Phase und hydrophobe Komponenten; das wären also neutrale oder über den pH-Wert neutralisierte Moleküle und Phasen mit einer hydrophoben Oberfläche, d.h. ein Minimum an aktiven polaren Zentren, das Ergebnis: Gute Peakform, wahrscheinlich gute Selektivität; die Chromatogramme sehen ähnlich aus, die Auswahl der stationären Phase ist von sekundärer Bedeutung
- Hydrophobe stationäre Phase und polare Komponenten; möglicherweise eine gute Peakform jedoch dürftige Selektivität (z. B. moderne endcappede Phasen und Cis-Trans-Isomere oder stärkere Basen)
- Polare stationäre Phase und hydrophobe Komponenten; wahrscheinlich geringe Retention und auch dürftige Selektivität
- Polare stationäre Phase und polare Komponenten; wahrscheinlich gute Selektivität; das Problem wären hier evtl. lange Retentionszeit und tailende Peaks
Natürlich kann und sollte die Selektivität durch Änderung folgender vier Faktoren überprüft bzw. bei Bedarf verbessert werden: Eluentenzusammensetzung, Art des organischen Lösungsmittels/Modifiers (Acetonitril, Methanol, Tetrahydrofuran, Ionenpaarreagenzien etc.) ∆ pH-Wert, ∆ Temperatur.